uv reactors, photo-oxidation, advanced oxidation (aop), recycling & engineering
for industrial use
Química de las reacciones de oxidación UV
Química de las reaciones de oxidación UV
Enviolet es el mayor especialista en procesos de oxidación avanzada (AOP) con aplicaciones industriales. En nuestros tratamientos, empleamos dos métodos distintos:
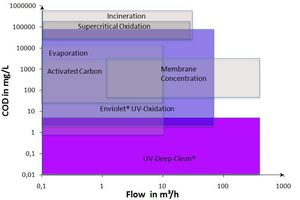
- Oxidación UV de disoluciones muy concentradas en medio homogéneo (proceso con H2O2/UV).
- Limpieza profunda UV: oxidación UV de disoluciones en medio heterogéneo para obtener una baja concentración final (UV/catalizador del proceso).
Fundamentos de la oxidación UV
Para que la fotorreacción de una molécula R se lleve a cabo, ésta tiene que absorber luz (Calbert y Pitts, 1966). La cantidad de luz absorbida A(λ) (absorbancia), que depende de la concentración (C), el espesor de la capa (d) y la abpsortividad molar ε(λ), viene descrita por la ley de Lambert- Beer, según la cual I(0) es la intensidad de la luz antes de la absorción e I la posterior.
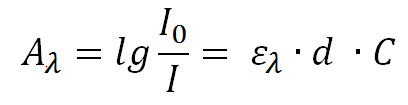
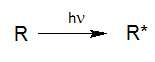
Mediante la absorción de luz con suficiente energía, se genera una molécula R* a partir de R mediante la elevación de su estado energético por la entrada de la energía fotónica. Esta absorción es un requisito básico para cualquier tipo de fotorreacción. Ésto significa que incluso soluciones que originalmente tenían un color muy oscuro, pueden ser tratadas mediante oxidación UV si los reactores se han diseñado y construido correctamente.
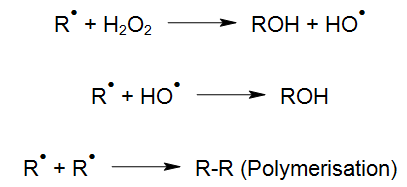
R* puede retornar a su estado inicial, ya sea directamente o a través de reactivos intermedios, o continuar reaccionando físicamente dando lugar a otros productos. Debido a los procesos químicos posteriores, radicales, iones, iones radicales o fragmentos estables son generados en soluciones acuosas y pueden continuar reaccionando a través de procesos térmicos.
En presencia de agentes oxidantes pueden producirse reacciones adicionales. Por ejemplo, con luz de una determinada longitud de onda, el peróxido de hidrógeno (H2O2) se puede descomponer mediante fotólisis (UV/H2O2) en radicales hidroxilo, altamente reactivos, que reaccionan con los elementos orgánicos e inorgánicos del agua (Laming et al. 1969, Baxton y Wilmarth 1963, Hochnadel 1962):
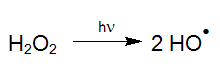
Los radicales hidroxilo (radicales OH), no sólo se generan con menos cantidad de productos químicos (Legrini et al. 1993), sino también con un aporte de energía económico (Bolton y Cater, 1994) procedente del proceso UV/H2O2. Debido a ésto, los procesos de oxidación avanzada (AOP) también pueden utilizarse eficazmente a altas concentraciones para eliminar contaminantes en soluciones acuosas, tales como: aguas residuales altamente contamindas, baños de galvanoplastia y aguas de proceso ultrapuras. Sin embrago, para los tratamientos a un nivel ppb, se utilizan catalizadores en lugar de H2O2 (ver limpieza UV en profundidad). La degradación de los compuestos orgánicos a través de radicales OH se inicia a traves de la abstracción de hidrógeno (Haber y Willstätter, 1931):
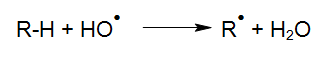
Cuando las olefinas están presentes, se produce la siguiente reacción de adición electrofílica de radicales OH:
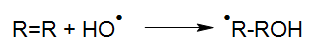
Tras el inicio de estas reacciones, existen varias posibilidades de reacción entre los radicales generados, En presencia de oxígeno, se forma un radical peroxilo:

En general, la polimerización no se considera una reacción favorable ya que los productos polimerizados pueden dar lugar a problemas de precipitación en la superficie de la lámpara ultravioleta. Por ésto, es importante evitarlos mediante un diseño y construcción del reactor UV adecuados. En este caso, puede ser necesario el uso de equipo adicional para lograr condiciones óptimas de reacción y un proceso de oxidación eficiente.
El radical peroxilo (RHO2*) puede continuar su reacción de la siguiente manera:
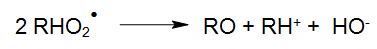
Los aldehídos resultantes, y por consiguiente las cetonas, se pueden oxidar a través de los procesos de reacción posteriores en ácidos carboxílicos y para ser sometidos a una descarboxilación térmica o fotoquímica (Weeks y Matheson, 1955).

Productos de descomposición típicos durante la oxidación ultravioleta
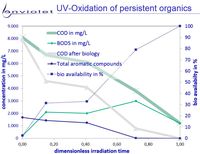
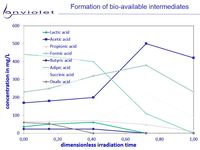
La oxidación UV y los AOP-UV en compuestos orgánicos recalcitrantes o tóxicos aumentan la biodisponibilidad de estas soluciones en casi todos los casos. Por ello, la DBO/DQO pasan de <5% a >>60%. En raras ocasiones la biodisponibilidad aumenta solo en pequeñas proporciones.
En la imagen "formación de productos de degradación" puede apreciarse claramente que la eliminación de compuestos recalcitrantes da lugar a la formación de carbonatos orgánicos muy favorables para la reducción biológica. Con todo ésto, queda claro que la oxidación UV conduce a una mejora de la calidad de las aguas residuales.
Cambios visibles en la calidad del agua tras someterla a oxidación UV
Representacion de los cambios de color del agua durante el tratamiento de aguas residuales industriales con el proceso de oxidación UV de Enviolet.