uv reactors, photo-oxidation, advanced oxidation (aop), recycling & engineering
for industrial use
Cyanide ontgiften
Afbraak van Cyanide
Cyanide, dat in water of afvalwater voorkomt, wordt in drie verschillende types onderverdeeld:
1.) Vrije Cyanide (ongebonden CN-)
2.) gemakkellijk vrijzetbare Cyanide (omvat CN- evenals zwak tot halfsterke complexen zoals Cu-cyanide, Ni-cyanide en Ag-cyanide)
3.) Totaal Cyanide (omvat alle voorgaande + zeer sterk gebonden cyanide, zoals complexen Cyanoferraat en Cobaltcyanide)
Deze indeling komt overeen met de parameters, die door de DIN analyse methode gedefinieerd zijn. Deze meetgrootheden zijn zogenaamd „Methode-afhankelijke“ parameters. Dat betekend dat een eenduidige rangschikking van Cyanide in water in de regel niet mogelijk is, dat er zelden enkel één vorm voorkomt en dat er over het algemeen een mengsel van verschillende metaal Cyano-complexen aanwezig is.
Cyanid-Oxidation met Hypochloriet
De behandeling van cyanide houdend afvalwater met Chloor, meestal onder vorm van hypochloriet, is de traditionele behandeling. Het was lange tijd de best beschikbare techniek, die met weinig investeringskosten tot de meest gewenste behandelingsresultaten voerde.
Meer en meer wordt het ontgiften met hypochloriet in vraag gesteld of moet in bedrijven vervangen worden:
1.) Door de reactie van organische bestanddelen met chloor, zoals bv. Tensiden en complexvormers, ontstaan er gechloreerde substanties (AOX) die dan de grenswaarden voor lozen overschrijden.
2.) Naast AOX ontstaan er ook andere problematische substanties, zoals traangas (CN-gas) in de eerste reactiefase en tegen het einde van de behandeling de toxische chlooramines.
3.) Al naar gelang de vorm van de aanwezige metalen, is een succesvolle ontgifting van het afvalwater lang durend of zelfs onmogelijk.
4.) Na een behandeling met Hypochloriet zijn er nog andere complexvormers aanwezig, die ervoor zorgen dat we grote hoeveelheden sulfide precipitatiemiddelen nodig hebben, om de metalen te kunnen neerslaan.
5.) Het verbruik van hypochloriet ligt in praktijk viermaal hoger dan het stoichiometrisch verbruik, omdat hypochloriet met Ammoniak tot tri-Chlooramine verder reageert. Tri-Chlooramine is in afvalwater niet toegelaten.
Overheden, zoals het Baden-Württembergische Ministerie voor Milieu, Klimaat en energiewetenschap, raden ondertussen de UV/H2O2 Cyanide-Behandeling aan, omdat dit een milieuvriendelijke behandeling is
UV/H2O2 Behandeling van Cyanide
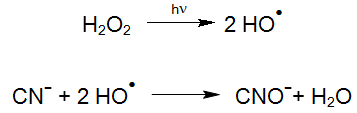
De fotochemische afbraak van Cyanide (UV-Oxidatie) gebeurt via een groot aantal van reacties, die naargelang de samenstelling van de waterstofhoudende componenten en bovengenoemde cyanidecomplexen, een uiteenlopende belangrijkheid hebben. Tot nog toe zijn de exacte reactiemechanismen voor het ontgiften van Cyanide met UV/H202 weing onderzocht en zijn in de literatuur deels tegenstrijdig aangegeven.
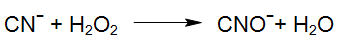
Zo is waterstofperoxide alleen, zonder UV straling, onder geschikte condities in staat om vrije en deels licht gebonden Cyaniden te oxideren. Naargelang de stabiliteit van het complex, zijn hiervoor veel langere behandelingstijden nodig dan wanneer er gebruik gemaakt wordt van een UV/H2O2 technologie (Enviolet®)
Voornamelijk bij de oxidatie van stabielere Metaal-Cyano verbindingen speelt de stimulans (exitatie) van de Metaal-Cyano complexen door UV-Straling (UV-Oxidatie / UV-H2O2-Oxidatie) een beduidende rol, doordat in geëxciteerde toestand, de reactie met waterstofperoxide sneller verloopt:
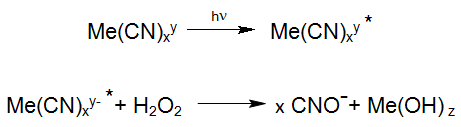
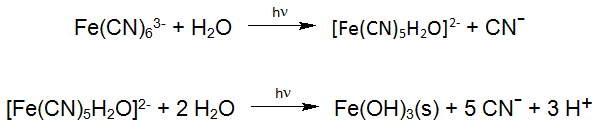
Als bekende fotochemische reactie kunnen we de afbraak van het stabiele Hexacyanoferraat vermelden. Hexacyanoferraat ontstaat bij de productie van zonnecellen en komt zo in het afvalwater terecht. Die reacties vinden bij het inzetten van industriële Enviolet® processen (UV +H202), voor het behandelen van Hexacyanoferraat houdend afvalwater plaats, met het doel de totale Cyanide af te bouwen (vb. Verichrome (U.K.): van ca. 1500 mg/L tot < 1 mg/L).
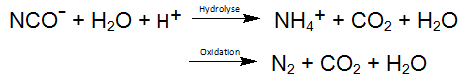
In overeenkomstige vergelijkingen, wordt de zo vrijgestelde cyanide tot Cyanaat geoxideerd. Een vergelijkbare reactie vindt plaats bij de fotolyse van de stabielste der MeCN, nl Kobaltcyanide. Het gevormde oxidatieproduct Cyanaat, in de hierboven beschreven reactievergelijking, reageert door hydrolyse tot kooldioxide en Ammonium, waarbij de oxidatie van cyanaat tot stikstof en CO2 als nevenreactie mogelijk is:
UV/H2O2 Behandeling van organische Cyanide
Naast de UV-Oxidatie van anorganische Cyanide, kunnen ook organische Cyaniden, d.w.z Nitrilen door Enviolet® geoxideerd worden, waarbij hier de reactie, die onder COD/TOC afbraak beschreven is, van toepassing is. Nitrilen kunnen onder bepaalde voorwaarden door Hydrolyse, Cyanide vrijmaken waardoor het water verder ontgift kan worden.
Cyanide oxidatie in reëel afvalwater

Cyanide oxidatie in reëel afvalwater
In afvalwater- of grondwaterbehandeling bestaat de belasting normaal niet enkel uit puur cyanide, daar tijdens industriële processen, tevens gebruik gemaakt werd van organische stoffen, zoals tensiden of organische complexvormers. Daarnaast komt afvalwater ook niet van één enkel productieproces voort, maar is bijna altijd gemengd met andere afvalwaterstromen komende van verschillende bronnen. Bij de behandeling van deze reële afvalwaters, zijn de reacties voor de cyanideafbouw in concurrentie met de reductie van de organische stoffen, die ook aanwezig zijn in het afvalwater. Om de ongewenste reacties te minimaliseren, worden de reactie vereisten en parameters van de UV-oxidatie aangepast volgens de watersamenstelling. Gedeeltelijk zijn bepaalde “Nevenreacties” ook gewenst en worden in de hand gewerkt, als deze bv. leiden tot de afbraak van organische complexvormers. Het inzetten van; Organosulfide voor het neerslaan van zware metalen, kan dan verminderd worden of meestal volledig vervallen.
Deze optimalisatiemogelijkheden, garanderen een zuinig proces met minimale investerings- en productiekosten, zeker bij complexe watersamenstellingen. Zo is het ook probleemloos mogelijk om afvalwater te behandelen, die zowel cyanide als EDTA bevatten (industriële toepassingen vb. Miba Gleitlager in Oostenrijk en DOW Zwitserland)
Cyanide-Oxidatie in grondwater
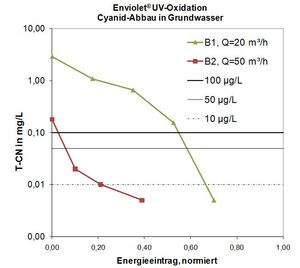
Het afbreken van Cyanide in grondwater d.m.v. UV-oxidatie (Enviolet®) is zonder meer mogelijk.
voorbeeld 1:
Actuele Concentraties van respectievelijk bronnen:
Bron 1: T-CN (Cyanide, totaal): 2,9 mg/L
Bron 2: T-CN (Cyanide, totaal): 0,18 mg/L
Doelstelling van de UV/H2O2 Processen:
Bereiken van de vereiste waarden, zijnde 50 µg/L
Cyanide verwijdering in industrieel afvalwater
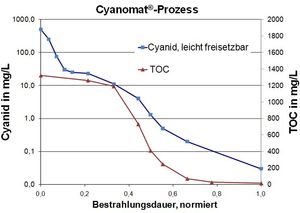
In industrieel afvalwater is cyanide-oxidatie meestal een voorbehandeling op metaalprecipitatie.
Voorbeeld: Cyanide- en EDTA houdend industrieafvalwater.
Typische afvalwaterwaardes:
Cyanide, (vrije cyanide): 550 mg/L
EDTA: 230 mg/L
TOC (totaal organisch koolstof): 1320 mg/L
Doelstelling van het UV/H2O2 Proces:
Bereiken van de grenswaarden van 0,2 mg/L vrije cyanide.
Afbreken van EDTA en andere organische complexvormers met UV-Oxidatie, gevolgd door metaalprecipitatie; die tot de metaalgrenswaarden moet leiden.
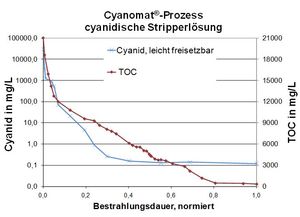
Cyanide-Oxidatie in Stripoplossingen
Betrouwbare afbraak van cyanide-complexe verbindingen in sterkl gekleurde vloeistoffen.
Veel stripoplossingen in de oppervlaktebehandeling bevatten cyanide om ongewenste metaallagen te verwijderen en een reductiemiddel om de daaronder liggende laag te beschermen. Deze stripoplossingen zijn zeer duur om als afval te verwerken, maar kunnen met ons Cyanomat®-Proces kostengunstig behandeld worden.
Voorbeeld: Cyanide houdend stripoplossing met typische afvalwaarden:
Cyanide, totaal: 50.000 mg/L
TOC (totaal organisch koolstof): 21.000 mg/L
Doelstelling van het UV/H2O2 Proces:
Behalen van de grenswaardes van 0,2 mg/L vrije cyanide.
Afbreken van organische bestanddelen (bv. Nitrobenzolsulfonaat) door UV-Oxidatie, gevolgd door metaalprecipitatie om tot de metaalgrenswaarden te komen.