uv reactors, photo-oxidation, advanced oxidation (aop), recycling & engineering
for industrial use
Elimination de cyanure
Classification des cyanures
Le cyanure qui peut se produire dans les eaux ou les eaux usées est classé en 3 catégories selon la force de la liaison au cyanure métallique:
1.) Cyanure libre (CN-)
2.) Cyanures dissociables faiblement acides (WAD) (se réfère aux complexes de cyanure libre et de cyanure avec des métaux tels que le cadmium, le cuivre, le nickel et le zinc)
3.) Dissociable aux acides forts (SADs) (se référer aux complexes de cyanure avec des métaux tels que le cobalt, l'or, le fer et l'argent)
4.) Cyanure total (se rapporte à toutes les catégories mentionnées ci-dessus et aux complexes très puissants ferro et ferri cyanures et cobalt cyanures)
Cette classification est en accord avec divers paramètres d'analyse. Normalement utilisé comme limites environnementales, on trouve d'abord le cyanure WAD, dont les valeurs mesurées correspondent presque exactement à celles obtenues par la méthode ISO / DIN (cyanure facilement libéré), et la seconde le cyanure total.
Ces paramètres dépendent des méthodes d'analyse spécifiées utilisées. En effet, il n'est pas possible de classer clairement le type de cyanure car il existe typiquement un mélange de différents métaux présents et par conséquent différents types de cyanures.
Cyanure-Oxydation avec une solution d'hypochlorite (liqueur de blanchiment au chlore)
Le traitement de chloration alcaline, qui utilise généralement de la liqueur de blanchiment au chlore, constitue le procédé traditionnel de destruction du cyanure dans les eaux usées.
Pendant longtemps, ce procédé était à la pointe de l'art, conduisant dans la majorité des cas aux concentrations de cyanure désirées avec des coûts d'investissement relativement faibles.
La désintoxication au cyanure par le chlore est de plus en plus remise en question et doit être souvent remplacée pour les raisons suivantes:
1.) Les réactions du chlore avec des substances organiques comme les tensioactifs ou complexants conduisent à la formation de composés organiques chlorés, détectés comme AOX (halogène organique absorbable) et conduisant à un dépassement des limites d'AOX.
2.) Non seulement AOX est formé, mais aussi d'autres substances problématiques chlorés peuvent être produites: Au début du traitement au chlore, le gaz lacrymogène chlorure de cyanogène et plus tard les chloramines toxiques.
3.) Selon la composition de l'eau en termes de métaux lourds, un traitement réussi peut être difficile et long, voire impossible.
4.) Après la désintoxication du cyanure avec l'hypochlorite, il existe encore des agents complexants organiques, qui nécessitent d'énormes quantités de sulfures ou de sulfures d'organes pour maintenir les limites des métaux lourds.
5.) En pratique la consommation de chlore liqueur dépasse la consommation stoechiométrique attendue 4 fois. Ceci est causé par la chloration de l'ammoniac qui se forme lors de la désintoxication au cyanure, générant des chloramines toxiques comme la trichloramine interdite.
Dans le même temps, les offices publics comme le "Ministeren für Umwelt, Klima und Energiewirtschaft" recommandent l'oxydation du cyanure par le procédé UV / H2O2 comme la technologie la plus respectueuse de l'environnement.
UV/H2O2 oxydation de cyanure
Un certain nombre de réactions conduisent à la dégradation photochimique des cyanures. Selon la composition de l'eau et du type de complexes présente des voies différentes peuvent se produire.
Les recherches sur les mécanismes exacts sont rares et dans la littérature les voies possibles sont décrites en partie de manière contradictoire.
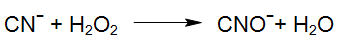
Même le peroxyde d'hydrogène seul, sans irradiation UV, conduit dans des conditions appropriées à l'oxydation du cyanure libre et d'une partie du cyanure des complexes cyaniques. Ces processus peuvent nécessiter des temps de réaction assez longs en fonction de la stabilité des complexes.
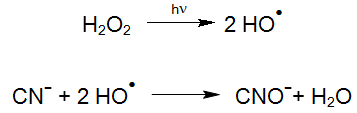
De plus, le radical hydroxyle hautement réactif généré par la photolyse du peroxyde d'hydrogène (procédé UV / H2O2) réagit rapidement avec le cyanure.
Pour l'oxydation de complexes métalliques de cyano plus forts, l'excitation de ces composés par irradiation UV joue un rôle important puisqu'ils peuvent réagir directement avec le peroxyde d'hydrogène lorsqu'ils sont excités:
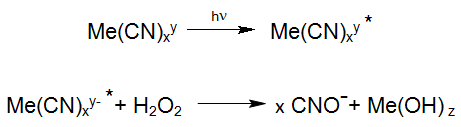
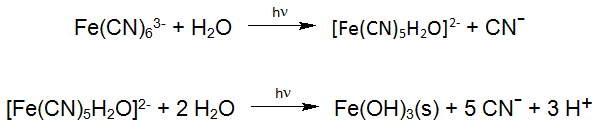
Une réaction photochimique connue est la dégradation des hexacyanoferrates stables, qui sont fréquemment étudiés dans la photochimie solaire des eaux de surface. Ces réactions se produisent également dans l'utilisation industrielle du procédé Enviolet® dans le traitement UV-H2O2 des eaux usées contenant de l'hexacyanoferrate, dans le but de réduire le cyanure total (par exemple Verichrome (UK): jusqu'à 1500 mg / L à <1 mg / L).
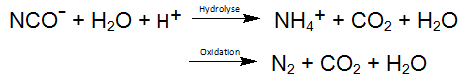
Selon les équations ci-dessus, le cyanure libéré est oxydé en cyanate. Une réaction similaire se produit même pendant la photolyse des complexes de cyanure de cobalt, qui est le complexe de MeCN le plus stable. La résultante des réactions oxydation décrites ci-dessus produits cyanate réagit facilement par hydrolyse au dioxyde de carbone et à l'ammonium, de sorte que l'oxydation du cyanate en azote et en dioxyde de carbone comme réaction secondaire est possible:
Traitement UV / H2O2 des cyanures organiques
En plus de l'oxydation UV du cyanure inorganique, les cyanures organiques, i. Les nitriles sont oxydés par la méthode Enviolet®, auquel cas les réactions décrites dans la dégradation DCO / COT se concrétisent. Les nitriles peuvent, dans certaines conditions, libérer du cyanure par hydrolyse, nécessitant ainsi une désintoxication appropriée de l'eau.
Oxydation du cyanure dans les eaux usées réelles

Dans le traitement des eaux usées ou des eaux souterraines, les impuretés cyanurées pures ne sont généralement pas présentes parce que leur utilisation industrielle nécessite généralement des ingrédients organiques tels que des tensioactifs ou des agents complexants organiques. De plus, il y a rarement des eaux usées provenant d'une chaîne de production, mais souvent mélangées avec d'autres types d'eaux usées, en partie provenant de sources diffuses.
Dans le traitement de ces effluents réels, les réactions mentionnées pour la dégradation du cyanure sont en concurrence avec les réactions des ingrédients organiques. Afin de minimiser les réactions indésirables, les conditions de réaction et les paramètres d'oxydation UV sont ajustés à la composition des eaux usées usuelle dans l'usine. Des "réactions secondaires" partielles mais également souhaitables sont encouragées si elles conduisent, par exemple, à la dégradation d'agents complexants organiques. L'utilisation d'organosulfure coûteux pour la précipitation de métaux lourds peut alors être réduite ou même complètement éliminée.
Ces options d'optimisation garantissent un processus économique avec des coûts d'investissement et d'exploitation minimes, même ou spécialement avec la composition complexe des eaux usées. Par exemple, le traitement des eaux usées contenant à la fois du cyanure et de l'EDTA est également possible (exemple industriel: Miba Gleitlager (Autriche), DOW (Suisse))
Oxydation du cyanure dans les eaux souterraines
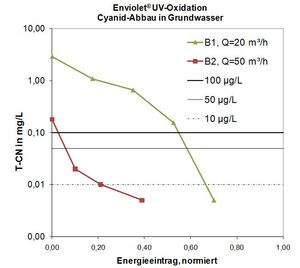
La dégradation des cyanures dans les eaux souterraines par oxydation UV est généralement possible.
Exemple 1
Concentrations actuelles du puits respectif:
Puits 1: T-CN (cyanure total): 2,9 mg / L
Puits 2: T-CN (cyanure, total): 0,18 mg / L
Objectif du procédé UV / H2O2:
Atteinte de la valeur cible de 50 μg / L par oxydation UV
la dégradation des cyanures dans les eaux usées industrielles
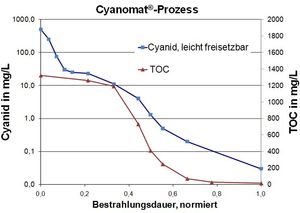
Dans les eaux usées industrielles, l'oxydation du cyanure est habituellement un prétraitements de la précipitation des métaux.
Exemple: Eaux usées industrielles contenant du cyanure et de l'EDTA.
Valeurs typiques des eaux usées:
Cyanure, facilement libéré: 550 mg / L
EDTA: 230 mg / L
COT (carbone organique total): 1320 mg / L
Objectif du procédé UV / H2O2:
Respect de la limite de 0,2 mg / L de cyanure facilement libérable.
Destruction de l'EDTA et d'autres agents complexants organiques par l'oxydation UV de sorte que la précipitation subséquente du métal conduise à la conformité avec les valeurs limites des métaux
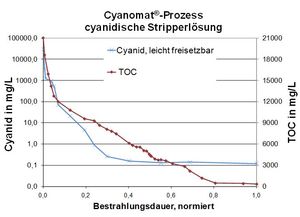
l'oxydation du cyanure dans la solution décapante
De nombreuses solutions de décapage dans le traitement de surface contiennent du cyanure pour éliminer la couche métallique indésirable et un agent réducteur pour protéger la couche sous-jacente. Ces décapants sont très coûteux à enlever et peuvent être traités à peu de frais dans notre procédé Cyanomat.
Exemple: solution de décapage au cyanure
Valeurs typiques des eaux usées:
Cyanure, total: 50 000 mg / L
COT (carbone organique total): 21 000 mg / L
Objectif du procédé UV / H2O2:
Respect de la limite de 0,2 mg / l facile à libérer du cyanure.
Destruction d'autres ingrédients organiques (par exemple le nitrobenzène sulfonate) par oxydation UV pour permettre la précipitation subséquente du métal afin de respecter les valeurs limites des métaux.